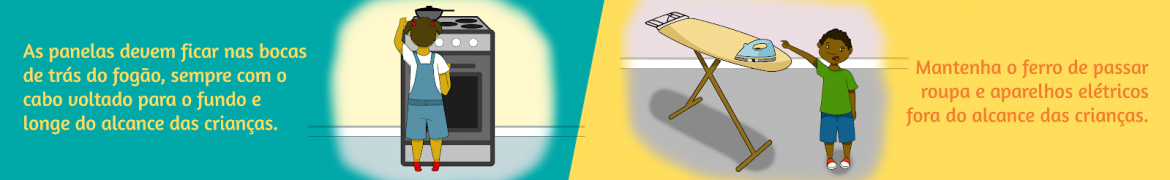
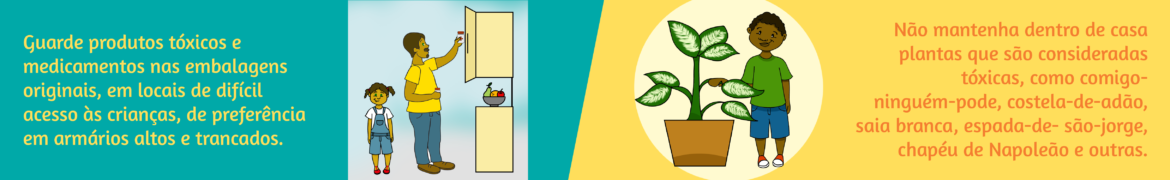
“Pílula do câncer”: Associação Brasileira de Saúde Coletiva pede veto à liberação do medicamento
O Projeto de Lei 4639/16, que autoriza a produção e o uso da fosfoetanolamina sintética aos pacientes com câncer mesmo antes da conclusão dos estudos que permitam à Agência Nacional de Vigilância Sanitária (Anvisa) analisar o pedido de registro definitivo dela como medicamento, foi aprovado pelo Senado Federal no dia 23 de março e aguarda a sanção ou o veto da Presidência da República. Tendo como objetivo o veto à liberação do medicamento, a Associação Brasileira de Saúde Coletiva encaminhou para a presidente Dilma Rousseff uma Carta Aberta. Confira o documento na íntegra:

A Carta está disponível no site da Abrasco
A professora do Departamento de Pediatria, Karla Rodrigues, explica os motivos que poderiam ter levado a Abrasco a pedir pelo veto da Presidência.
A descoberta de novos produtos medicinais envolve em geral, a pesquisa em laboratório e testes em animais (estudo pré-clínico) antes dos testes em humanos (estudos clínicos), para que, assim, a nova droga possa ser liberada como opção terapêutica. É obrigatório que ocorram estudos clínicos antes que novos medicamentos sejam liberados para a população.

Foto: USP
Os estudos pré-clínicos são capazes de identificar os efeitos de uma nova droga em seres humanos de forma parcial. Segundo Karlberg & Speers (2010), apenas um entre 14 novos medicamentos que entram em programas de avaliação clínica são lançados para uso clínico, em geral, devido aos efeitos colaterais imprevistos ou aos efeitos terapêuticos insuficientes. “Os estudos clínicos devem seguir as Boas Práticas Clínicas, que constituem um padrão de qualidade científica e ética internacional que garantem o desenho, realização, registro e relato dos estudos que envolvem a participação de humanos. A conformidade com este padrão oferece garantia pública que os direitos, segurança e bem-estar dos participantes do estudo estão protegidos, consistente com os princípios que têm origem na Declaração de Helsinque, e que os dados do estudo clínico são confiáveis” (Diretriz ICH GCP E6, 1996).
Cada país tem sua própria agência reguladora de medicamentos. No Brasil, a Agência Nacional de Vigilância Sanitária (ANVISA) é o órgão responsável por analisar a segurança e a eficácia dos medicamentos. Portanto, a liberação de uma nova medicação, sem aprovação deste pelo órgão competente, põe em risco a saúde da população.
Referência
Karlberg JPE & Speers MA. Revisão de Estudos Clínicos: Um Guia para o Comitê de Ética. Hong Kong, 2010. Acessado em 10 de abril de 2016: http://www.pfizer.com/files/research/research_clinical_trials/ethics_committee_guide_portugese.pdf
Karla Emília de Sá Rodrigues é oncologista e professora do Departamento de Pediatria da Faculdade de Medicina da Universidade Federal de Minas Gerais.
Saiba mais: Abrasco não apoia a liberação da “pílula do câncer”